Klavyeah
Üye
- Katılım
- 28 Ağu 2006
- Mesajlar
- 269
- Puanları
- 1
- Yaş
- 40
Yarı İletkenlerin Tanıtılması
ANALOG ELEKTRONİK
Konular:
1.1 Atomik Yapı
1.2 Yarıiletken, İletken ve Yalıtkan
1.3 Yarıiletkenlerde İletkenlik
1.4 N Tipi ve P tipi Yarıiletkenler
1.5 PN Bitişimi (eklemi) ve Diyot
1.6 PN Bitişiminin Önbeslemesi
Amaçlar:
Bu bölümü bitirdiğinizde aşağıda belirtilen konular hakkında ayrıntılı bilgiye sahip
olacaksınız.
• Maddenin temel atomik yapısı
• Atom numarası ve ağırlığı, elektron kabukları ve yörüngeler, Valans elektronları,
iyonizasyon
• Yarıiletken, iletken ve yalıtkan. Enerji bandları, Silisylum ve germanyum
• Yarıiletkenlerde iletkenlik, elektronlar ve boşluklarda iletkenlik,
• N tipi ve P tipi maddenin oluşturulması; Katkı işlemi
• PN eklemi ve temel işlevleri
• PN ekleminin önbeslenmesi
• Diyot karakteristikleri
Kullandığımız pek çok cihazın üretiminde bir veya birkaç elektronik devre elemanı
kullanılmaktadır. Elektronik devre elemanları ise yarıiletken materyaller kullanılarak
üretilir. Diyot, transistör, tristör, FET, tümdevre (entegre) v.b adlarla tanımlanan
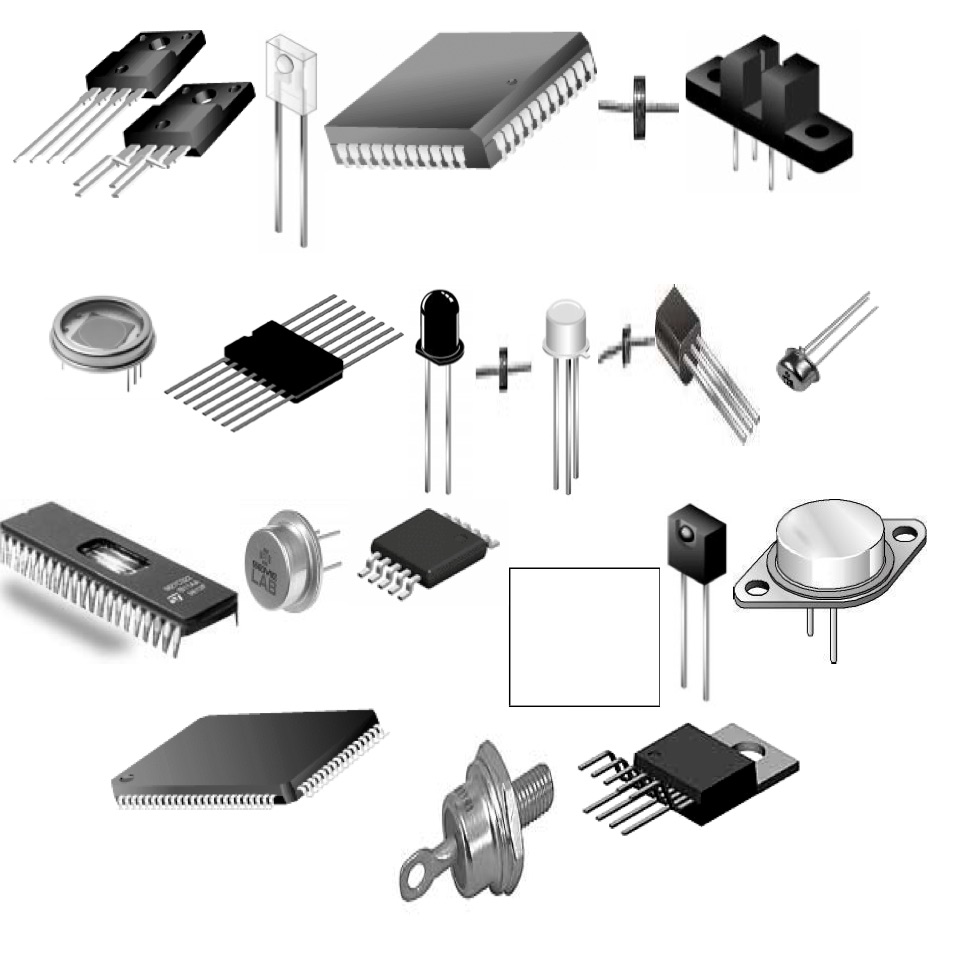
elektronik devre elemanlarının bir çoğu şekil-1.1’de resimlenmiştir.
Elektronik devre elemanlarının dolayısıyla elektronik cihazların nasıl çalıştığını anlamak
için yarıiletken materyallerinin yapısı hakkında bilgiye gereksinim duyarız. Bu bilgiyi
ulaşmanın en etkin yolu maddenin temel atomik yapısını incelemekle başlar.
Bu kitap boyunca elektronik devre elemanlarını belirli bir sıra içerisinde tanıyacağız. Bu
elemanların tüm özelliklerini inceleyerek cihaz tasarımlarını gerçekleştireceğiz.
ATOMİK YAPI
Tüm maddeler atomlardan oluşur. Atomlar ise; elektronlar, protonlar ve nötronlardan
meydana gelir. Elektrik enerjisinin oluşturulmasını ve kontrol edilmesini maddenin
atomik yapısı belirler. Atomik yapıya bağlı olarak tüm elementler; iletken, yalıtkan
veya yarıiletken olarak sınıflandırılırlar.
Elektronik endüstrisinde temel devre elemanlarının üretiminde yarıiletken materyaller
kullanılır. Günümüzde elektronik devre elemanı üretiminde kullanılan iki temel
materyal vardır. Bu materyaller; silisyum ve germanyumdur.
İletken, yalıtkan ve yarıiletken maddelerin işlevlerini ve özelliklerini incelemek için
temel atomik yapının bilinmesi gerekir.
Bu bölümde temel atomik yapıyı inceleyeceğiz. Bölüm sonunda aşağıda belirtilen
konular hakkında bilgi edineceksiniz.
• Çekirdek, proton, nötron ve elektron
• Atom ağırlığı ve atom numarası
• Yörünge
• Valans elektronları
• İyonisazyon
Yeryüzünde bilinen 109 element vardır. Bir elementin özelliklerini belirleyen en küçük
yapıtaşı ise atomlardır. Bilinen bütün elementlerin atomik yapıları birbirinden farklıdır.
Atomların birleşmesi elementleri meydana getirir.
Klasik bohr modeline göre atom, şekil-1.1’de gösterildiği gibi 3 temel parçacıktan oluşur.
Bunlar; elektron, proton ve nötron’dur. Atomik yapıda; nötron ve protonlar merkezdeki
çekirdeği oluşturur. Çekirdek artı yüklüdür. Elektronlar ise çekirdek etrafında sabit bir
yörüngede dolaşırlar ve negatif yüklüdürler.
Elektronlar, negatif yükün temel nesneleridirler. Bilinen bütün elementleri bir birinden
ayıran temel özellik, atomlarında bulunan proton ve nötron sayılarıdır. Her bir atomun,
proton ve nötron sayıları faklıdır. Örneğin, en basit yapıya sahip atom, hidrojen
atomudur. Hidrojen atomu; şekil-1.2.a’da gösterildiği gibi bir proton ve bir elektrona
sahiptir. Şekil-1.2.b’de gösterilen helyum atomunun yörüngesinde iki elektron,
çekirdeğinde ise; iki proton ve iki nötron bulunmaktadır.
1 Protonlu çekirdek
2 Protonlu ve 2 Nötronlu çekirdek
Çekirdek yörüngesinde
1 elekton
Çekirdek yörüngesinde
2 elekton
Atom Numarası ve Ağırlığı
Bütün elementler atom numaralarına uygun olarak periyodik tabloda belirli bir düzen
içinde dizilmişlerdir. Proton sayıları ile elektron sayıları eşit olan atomlar, elektriksel
açıdan kararlı (nötral) atomlardır. Elementler, atom ağırlığına göre de belirli bir düzen
içindedirler. Atom ağırlığı yaklaşık olarak çekirdekteki proton sayıları ile nötron
sayılarının toplamı kadardır. Örneğin hidrojenin atom numarası 1’dir ve atom ağırlığı da
1’dir. Helyumun atom numarası 2’dir ve atom ağırlığı ise 4’ tür. Normal veya tarafsız
durumda verilen her hangi bir elementin bütün atomlarındaki; elektron ve proton
sayıları eşittir.
Elektron Kabukları ve Yörüngeler
Bir atomun, elektron içeren yörüngeleri çekirdekten belirli uzaklıktadır. Çekirdeğe yakın
olan yörüngedeki elektronlar, çekirdeğe uzak olan yörüngedeki elektronlardan daha az
enerjiye sahiptir. Çekirdeğe farklı uzaklıklarda bulunan yörüngelerdeki elektronlar
belirli enerji seviyelerine uyar. Atomda, enerji bantları şeklinde gruplaşmış yörüngeler
“kabuk (shell)” olarak bilinirler. Verilen her bir atom, sabit kabuk sayısına sahiptir.
Kabuklarda barınan elektronlar ise belirli bir sistem dahilinde dizilirler.
Her bir kabuk, izin verilen sayıda maksimum elektron barındırır. Bu elektronların enerji
seviyeleri değişmez. Kabuk içindeki elektronların enerji seviyeleri bir birinden azda olsa
küçük farklılıklar gösterir. Fakat; kabuklar arasındaki enerji seviyelerinin farkı çok daha
büyüktür.
Çekirdek etrafında belirli bir yörüngeyi oluşturan kabuklar, k-l-m-n olarak gösterilirler.
Çekirdeğe en yakın olan kabuk k ‘dır. k ve l kabukları şekil-1.4 ‘de gösterilmiştir.
enerji seviyesi
1. Kabuk W1
2. Kabuk
Çekirdek
W= Enerji
r = Çekirdekten uzaklık
Bu elektron, en düşük
enerjiye sahiptir.
Bu elektron, en yüksek
enerjiye sahiptir.
Valans Elektronları
Elektronlar çekirdekten uzaktadır ve çekirdekten ayrılma eğilimindedir. Çekirdek
elektronun bu ayrılma eğilimini dengeleyecek güçtedir. Çünkü elektron negatif yüklü,
çekirdek pozitif yüklüdür. Çekirdekten uzakta olan elektronun negatif yükü daha fazladır.
Bu durum merkezden kaçma kuvvetini dengelemektedir. Bir atomun en dıştaki kabuğu, en
yüksek enerji seviyeli elektronlara sahiptir. Bu durum onu atomdan ayrılmaya daha eğilimli
hale getirir. Valans (atomun değerini ayarlayan elektronlar) elektronları kimyasal reaksiyona
ve malzemenin yapısına katkı sağlar.
Bir atomun en dış kabuğundaki elektronlar, çekirdek etrafında simetrik olarak hareket
ederler ve kendi aralarında bir bağ oluştururlar. Bu bağa “kovelant bağ” denir. Atomun en
dış kabuğundaki elektronlara ise “valans elektron” adı verilir. Komşu atomların en dış
kabuklarındaki elektronlar (valans elektronlar) kendi aralarında valans çiftleri oluştururlar.
İyonizasyon
Bir atom, ısı kaynağından veya ışıktan enerjilendiği zaman elektronlarının enerji seviyeleri
yükselir. Elektronlar enerji kazandığında çekirdekten daha uzak bir yörüngeye yerleşir.
Böylece Valans elektronları daha fazla enerji kazanır ve atomdan uzaklaşma eğilimleri artar.
Bir valans elektronu yeterli miktarda bir enerji kazandığında ancak bir üst kabuğa çıkabilir
ve atomun etkisinden kurtulabilir.
Bir atom, pozitif şarjın aşırı artması (protonların elektronlardan daha fazla olması)
durumunda nötr değere ulaşmaya çalışır. Bu amaçla atom, valans elektronlarını harekete
geçirir. Valans elektronunu kaybetme işlemi “İYONİZASYON” olarak bilinir ve atom pozitif
şarj ile yüklenmiş olur ve pozitif iyon olarak adlandırılır. Örneğin; hidrojenin kimyasal
sembolü H’dır. Hidrojenin valans elektronları kaybedildiğinde pozitif iyon adını alır ve H+
olarak gösterilir. Atomdan kaçan valans elektronları “serbest elektron” olarak adlandırılır.
Serbest elektronlar, nötr hidrojen atomunun en dış kabuğuna doğru akar. Atom negatif yük
ile yüklendiğinde (elektronların prontonlardan fazla olması) negatif iyon diye adlandırılırlar
ve H- olarak gösterilirler.
YARIİLETKEN, İLETKEN VE YALITKAN
Büyün materyaller; elektrik enerjisine gösterdikleri tepkiye bağlı olarak başlıca 3 gruba
ayrılırlar. Bu guruplar; iletken, yalıtkan ve yarıiletken olarak tanımlanır. Bu bölümde;
özellikle yarıiletken maddelerin temel yapısını inceleyerek, iletken ve yalıtkan maddelerle
aralarındaki farkları ortaya koymaya çalışacağız.
Bu bölümü bitirdiğinizde aşağıda belirtilen konularda ayrıntılı bilgiye sahip olacaksınız.
• Atomik yapının özü
• Bakır, silisyum, germanyum ve karbon v.b maddelerin atomik yapıları
• İletkenler
• Yarıiletkenler
• İletken ve yarıiletken arasındaki farklar
• Silisyum ve germanyum yarıiletken malzemelerin farklılıkları
Tüm materyaller atomlardan oluşur. Materyallerin atomik yapısı, materyalin elektrik
enerjisine karşı gösterecekleri tepkiyi belirler. Genel bir atomik yapı; merkezde bir
çekirdek ve çekirdeği çevreleyen yörüngelerden oluşmaktadır. Materyalin iletken veya
yalıtkan olmasında atomik yörüngede bulunan elektron sayısı çok önemlidir.
İletken
Elektrik akımının iletilmesine kolaylık gösteren materyallere iletken denir. İyi bir iletken
özelliği gösteren materyallere örnek olarak, bakır, gümüş, altın ve aliminyumu
sayabiliriz. Bu materyallerin ortak özelliği tek bir valans elektronuna sahip olmalarıdır.
Dolayısı ile bu elektronlarını kolaylıkla kaybedebilirler. Bu tür elementler; 1 veya birkaç
valans elektrona sahiptirler. Örneğin bakır, altın, gümüş v.b ….

ANALOG ELEKTRONİK
Konular:
1.1 Atomik Yapı
1.2 Yarıiletken, İletken ve Yalıtkan
1.3 Yarıiletkenlerde İletkenlik
1.4 N Tipi ve P tipi Yarıiletkenler
1.5 PN Bitişimi (eklemi) ve Diyot
1.6 PN Bitişiminin Önbeslemesi
Amaçlar:
Bu bölümü bitirdiğinizde aşağıda belirtilen konular hakkında ayrıntılı bilgiye sahip
olacaksınız.
• Maddenin temel atomik yapısı
• Atom numarası ve ağırlığı, elektron kabukları ve yörüngeler, Valans elektronları,
iyonizasyon
• Yarıiletken, iletken ve yalıtkan. Enerji bandları, Silisylum ve germanyum
• Yarıiletkenlerde iletkenlik, elektronlar ve boşluklarda iletkenlik,
• N tipi ve P tipi maddenin oluşturulması; Katkı işlemi
• PN eklemi ve temel işlevleri
• PN ekleminin önbeslenmesi
• Diyot karakteristikleri
Kullandığımız pek çok cihazın üretiminde bir veya birkaç elektronik devre elemanı
kullanılmaktadır. Elektronik devre elemanları ise yarıiletken materyaller kullanılarak
üretilir. Diyot, transistör, tristör, FET, tümdevre (entegre) v.b adlarla tanımlanan
elektronik devre elemanlarının bir çoğu şekil-1.1’de resimlenmiştir.
Elektronik devre elemanlarının dolayısıyla elektronik cihazların nasıl çalıştığını anlamak
için yarıiletken materyallerinin yapısı hakkında bilgiye gereksinim duyarız. Bu bilgiyi
ulaşmanın en etkin yolu maddenin temel atomik yapısını incelemekle başlar.
Bu kitap boyunca elektronik devre elemanlarını belirli bir sıra içerisinde tanıyacağız. Bu
elemanların tüm özelliklerini inceleyerek cihaz tasarımlarını gerçekleştireceğiz.
ATOMİK YAPI
Tüm maddeler atomlardan oluşur. Atomlar ise; elektronlar, protonlar ve nötronlardan
meydana gelir. Elektrik enerjisinin oluşturulmasını ve kontrol edilmesini maddenin
atomik yapısı belirler. Atomik yapıya bağlı olarak tüm elementler; iletken, yalıtkan
veya yarıiletken olarak sınıflandırılırlar.
Elektronik endüstrisinde temel devre elemanlarının üretiminde yarıiletken materyaller
kullanılır. Günümüzde elektronik devre elemanı üretiminde kullanılan iki temel
materyal vardır. Bu materyaller; silisyum ve germanyumdur.
İletken, yalıtkan ve yarıiletken maddelerin işlevlerini ve özelliklerini incelemek için
temel atomik yapının bilinmesi gerekir.
Bu bölümde temel atomik yapıyı inceleyeceğiz. Bölüm sonunda aşağıda belirtilen
konular hakkında bilgi edineceksiniz.
• Çekirdek, proton, nötron ve elektron
• Atom ağırlığı ve atom numarası
• Yörünge
• Valans elektronları
• İyonisazyon
Yeryüzünde bilinen 109 element vardır. Bir elementin özelliklerini belirleyen en küçük
yapıtaşı ise atomlardır. Bilinen bütün elementlerin atomik yapıları birbirinden farklıdır.
Atomların birleşmesi elementleri meydana getirir.
Klasik bohr modeline göre atom, şekil-1.1’de gösterildiği gibi 3 temel parçacıktan oluşur.
Bunlar; elektron, proton ve nötron’dur. Atomik yapıda; nötron ve protonlar merkezdeki
çekirdeği oluşturur. Çekirdek artı yüklüdür. Elektronlar ise çekirdek etrafında sabit bir
yörüngede dolaşırlar ve negatif yüklüdürler.
Elektronlar, negatif yükün temel nesneleridirler. Bilinen bütün elementleri bir birinden
ayıran temel özellik, atomlarında bulunan proton ve nötron sayılarıdır. Her bir atomun,
proton ve nötron sayıları faklıdır. Örneğin, en basit yapıya sahip atom, hidrojen
atomudur. Hidrojen atomu; şekil-1.2.a’da gösterildiği gibi bir proton ve bir elektrona
sahiptir. Şekil-1.2.b’de gösterilen helyum atomunun yörüngesinde iki elektron,
çekirdeğinde ise; iki proton ve iki nötron bulunmaktadır.
1 Protonlu çekirdek
2 Protonlu ve 2 Nötronlu çekirdek
Çekirdek yörüngesinde
1 elekton
Çekirdek yörüngesinde
2 elekton
Atom Numarası ve Ağırlığı
Bütün elementler atom numaralarına uygun olarak periyodik tabloda belirli bir düzen
içinde dizilmişlerdir. Proton sayıları ile elektron sayıları eşit olan atomlar, elektriksel
açıdan kararlı (nötral) atomlardır. Elementler, atom ağırlığına göre de belirli bir düzen
içindedirler. Atom ağırlığı yaklaşık olarak çekirdekteki proton sayıları ile nötron
sayılarının toplamı kadardır. Örneğin hidrojenin atom numarası 1’dir ve atom ağırlığı da
1’dir. Helyumun atom numarası 2’dir ve atom ağırlığı ise 4’ tür. Normal veya tarafsız
durumda verilen her hangi bir elementin bütün atomlarındaki; elektron ve proton
sayıları eşittir.
Elektron Kabukları ve Yörüngeler
Bir atomun, elektron içeren yörüngeleri çekirdekten belirli uzaklıktadır. Çekirdeğe yakın
olan yörüngedeki elektronlar, çekirdeğe uzak olan yörüngedeki elektronlardan daha az
enerjiye sahiptir. Çekirdeğe farklı uzaklıklarda bulunan yörüngelerdeki elektronlar
belirli enerji seviyelerine uyar. Atomda, enerji bantları şeklinde gruplaşmış yörüngeler
“kabuk (shell)” olarak bilinirler. Verilen her bir atom, sabit kabuk sayısına sahiptir.
Kabuklarda barınan elektronlar ise belirli bir sistem dahilinde dizilirler.
Her bir kabuk, izin verilen sayıda maksimum elektron barındırır. Bu elektronların enerji
seviyeleri değişmez. Kabuk içindeki elektronların enerji seviyeleri bir birinden azda olsa
küçük farklılıklar gösterir. Fakat; kabuklar arasındaki enerji seviyelerinin farkı çok daha
büyüktür.
Çekirdek etrafında belirli bir yörüngeyi oluşturan kabuklar, k-l-m-n olarak gösterilirler.
Çekirdeğe en yakın olan kabuk k ‘dır. k ve l kabukları şekil-1.4 ‘de gösterilmiştir.
enerji seviyesi
1. Kabuk W1
2. Kabuk
Çekirdek
W= Enerji
r = Çekirdekten uzaklık
Bu elektron, en düşük
enerjiye sahiptir.
Bu elektron, en yüksek
enerjiye sahiptir.
Valans Elektronları
Elektronlar çekirdekten uzaktadır ve çekirdekten ayrılma eğilimindedir. Çekirdek
elektronun bu ayrılma eğilimini dengeleyecek güçtedir. Çünkü elektron negatif yüklü,
çekirdek pozitif yüklüdür. Çekirdekten uzakta olan elektronun negatif yükü daha fazladır.
Bu durum merkezden kaçma kuvvetini dengelemektedir. Bir atomun en dıştaki kabuğu, en
yüksek enerji seviyeli elektronlara sahiptir. Bu durum onu atomdan ayrılmaya daha eğilimli
hale getirir. Valans (atomun değerini ayarlayan elektronlar) elektronları kimyasal reaksiyona
ve malzemenin yapısına katkı sağlar.
Bir atomun en dış kabuğundaki elektronlar, çekirdek etrafında simetrik olarak hareket
ederler ve kendi aralarında bir bağ oluştururlar. Bu bağa “kovelant bağ” denir. Atomun en
dış kabuğundaki elektronlara ise “valans elektron” adı verilir. Komşu atomların en dış
kabuklarındaki elektronlar (valans elektronlar) kendi aralarında valans çiftleri oluştururlar.
İyonizasyon
Bir atom, ısı kaynağından veya ışıktan enerjilendiği zaman elektronlarının enerji seviyeleri
yükselir. Elektronlar enerji kazandığında çekirdekten daha uzak bir yörüngeye yerleşir.
Böylece Valans elektronları daha fazla enerji kazanır ve atomdan uzaklaşma eğilimleri artar.
Bir valans elektronu yeterli miktarda bir enerji kazandığında ancak bir üst kabuğa çıkabilir
ve atomun etkisinden kurtulabilir.
Bir atom, pozitif şarjın aşırı artması (protonların elektronlardan daha fazla olması)
durumunda nötr değere ulaşmaya çalışır. Bu amaçla atom, valans elektronlarını harekete
geçirir. Valans elektronunu kaybetme işlemi “İYONİZASYON” olarak bilinir ve atom pozitif
şarj ile yüklenmiş olur ve pozitif iyon olarak adlandırılır. Örneğin; hidrojenin kimyasal
sembolü H’dır. Hidrojenin valans elektronları kaybedildiğinde pozitif iyon adını alır ve H+
olarak gösterilir. Atomdan kaçan valans elektronları “serbest elektron” olarak adlandırılır.
Serbest elektronlar, nötr hidrojen atomunun en dış kabuğuna doğru akar. Atom negatif yük
ile yüklendiğinde (elektronların prontonlardan fazla olması) negatif iyon diye adlandırılırlar
ve H- olarak gösterilirler.
YARIİLETKEN, İLETKEN VE YALITKAN
Büyün materyaller; elektrik enerjisine gösterdikleri tepkiye bağlı olarak başlıca 3 gruba
ayrılırlar. Bu guruplar; iletken, yalıtkan ve yarıiletken olarak tanımlanır. Bu bölümde;
özellikle yarıiletken maddelerin temel yapısını inceleyerek, iletken ve yalıtkan maddelerle
aralarındaki farkları ortaya koymaya çalışacağız.
Bu bölümü bitirdiğinizde aşağıda belirtilen konularda ayrıntılı bilgiye sahip olacaksınız.
• Atomik yapının özü
• Bakır, silisyum, germanyum ve karbon v.b maddelerin atomik yapıları
• İletkenler
• Yarıiletkenler
• İletken ve yarıiletken arasındaki farklar
• Silisyum ve germanyum yarıiletken malzemelerin farklılıkları
Tüm materyaller atomlardan oluşur. Materyallerin atomik yapısı, materyalin elektrik
enerjisine karşı gösterecekleri tepkiyi belirler. Genel bir atomik yapı; merkezde bir
çekirdek ve çekirdeği çevreleyen yörüngelerden oluşmaktadır. Materyalin iletken veya
yalıtkan olmasında atomik yörüngede bulunan elektron sayısı çok önemlidir.
İletken
Elektrik akımının iletilmesine kolaylık gösteren materyallere iletken denir. İyi bir iletken
özelliği gösteren materyallere örnek olarak, bakır, gümüş, altın ve aliminyumu
sayabiliriz. Bu materyallerin ortak özelliği tek bir valans elektronuna sahip olmalarıdır.
Dolayısı ile bu elektronlarını kolaylıkla kaybedebilirler. Bu tür elementler; 1 veya birkaç
valans elektrona sahiptirler. Örneğin bakır, altın, gümüş v.b ….
